Una granja comercial de gran tamaño (>2000 cerdas) en el este de China informa de un trastorno inusual de opacidad ocular y ceguera en varias camadas de lechones lactantes. Las cerdas comen y amamantan con normalidad. El número de lechones nacidos muertos y débiles se sitúa ligeramente por encima de lo normal y la mortalidad predestete es elevada. Se observa ceguera, opacidad corneal e inflamación de la zona ocular en unos pocos cerdos de varias camadas (imagen 1).

Imagen 1. Cerdo con opacidad corneal.
Los cerdos afectados están deprimidos, letárgicos y son incapaces de mamar. Se indica que la tasa de abortos es algo elevada, pero no se observan tormentas de abortos. El número de cerdos momificados está dentro de los parámetros normales. No se notifican otros signos clínicos. Una revisión rápida de los datos reproductivos parece descartar una posible causa genética, ya que líneas genéticas no relacionadas en la granja parecen verse afectadas de manera similar.

El diagnóstico diferencial incluye la enfermedad del ojo azul (Orthorubulavirus porcino) e infección bacteriana del ojo. La enfermedad del ojo azul está causada por un paramixovirus y es endémica en algunas partes de México. Provoca síntomas en el sistema nervioso central, neumonía y problemas reproductivos en cerdos reproductores, incluido orquitis y lesiones en la córnea en verracos, pero no se ha detectado en China ni en ningún otro lugar fuera de México. El diagnóstico preliminar de la enfermedad del ojo azul se haría mediante la observación de signos clínicos inusuales y se confirmaría mediante PCR y aislamiento del virus.
La deficiencia de vitamina A podría causar lesiones oculares graves, pero es bastante improbable en esta granja comercial de gran tamaño que alimenta a los animales con dietas modernas.
Diagnóstico
Uno de los cerdos afectados es sacrificado de forma humanitaria y diseccionado por el personal de la granja. Se envían al laboratorio muestras de tejidos frescos y fijados en formol (hígado, linfonodos, cerebro) y los ojos frescos del lechón de la foto (imagen 1).
Aparte de la lesión ocular, el personal de la granja no observa lesiones macroscópicas. El líquido intraorbitario aspirado de los ojos parece claro y normal. El frotis de líquido ocular teñido con tinción de Giemsa revela algunas células mononucleares y algunas bacterias en forma de bastón (bacilos). Unas cuantas Escherichia coli sin importancia son aisladas del líquido ocular. Se descarta la posibilidad de una causa bacteriana. Las muestras de linfonodos, cerebro e hígado fijadas en formol se procesan mediante un método rápido de inclusión en parafina para secciones de tejido que se tiñen con hematoxilina y eosina (H&E).
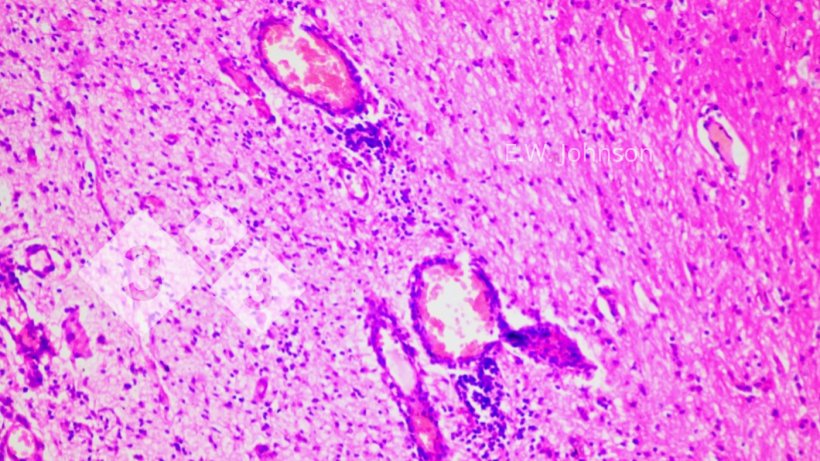
Imagen 2. Manguitos perivasculares y gliosis. Cerebro.
El examen microscópico del cerebro revela una meningoencefalitis con manguitos perivasculares y gliosis (imagen 2) e infiltración de las meninges con células inflamatorias mixtas mononucleares y polimorfonucleares (imagen 3).
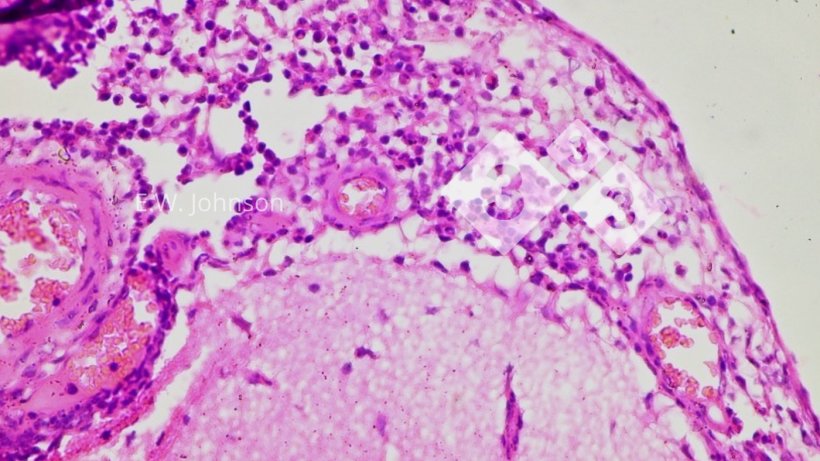
Imagen 3. Meningitis con células mononucleares y algunas células polimorfonucleares. Cerebro.
Se observa necrosis focal en el hígado y cuerpos de inclusión intranucleares anfofílicos en el tejido que rodea las áreas de necrosis (imagen 4). Se realiza un diagnóstico presuntivo de Enfermedad de Aujeszky (EA).
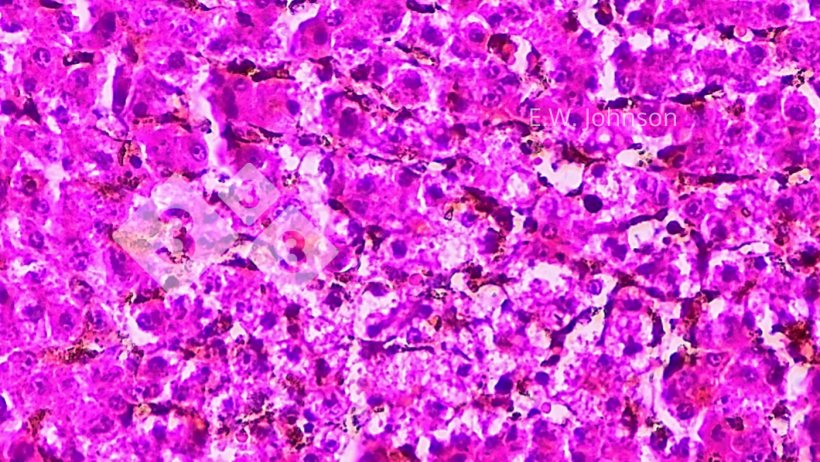
Imagen 4. Necrosis hepática focal con cuerpos de inclusión intranucleares anfofílicos ocasionales en la zona perinecrótica. Hígado.
La PCR del humor vítreo del ojo amplifica el ADN del gen US8 (“secuencia única corta” 8) del Suid alphaherpesvirus 1 (Virus de Aujeszky) que codifica la glioproteína E (gE), lo que confirma la presencia del virus de campo de la EA. La secuenciación del fragmento amplificado de US8 revela que el virus detectado se agrupa con cepas de variantes emergentes recientes de EA de tipo 2 común en China (imagen 5).
Se sabía que la granja era seropositiva para anticuerpos ADVgE. Las cerdas previamente infectadas serán seropositivas a largo plazo para ADV gE y transmitirán anticuerpos anti-gE a sus lechones, lo que los hará seropositivos para ADV hasta las 15 semanas de edad. Por lo tanto, cuando las cerdas son en su mayoría seropositivas, la prueba de anticuerpos en lechones jóvenes no es útil para el diagnóstico de la enfermedad. Pueden diagnosticarse falsos positivos de EA cuando no se comprende la persistencia de los anticuerpos gE maternos.
Resultado
La granja indicó que, cuando las primerizas positivas a PRV entraron en la granja de reproductoras, la amenaza de la peste porcina africana alteró la vacunación rutinaria contra la pseudorabia. El fallo en el programa de vacunación para PRV fue resuelto y la granja no ha notificado más casos similares.
![Imagen 5. Árbol filogenético PhyML - PRV gE que muestra cepas de tipo1 (similar a kaplan/becker), cepas "clásicas" de tipo 2 (similar a Fa/SC/Ea) y cepas de tipo 2 de mayor virulencia (similar a TJ/hb1201). Casos recientes de PRV, este caso [20-1048] y la encefalitis humana PRV hSD1-2019 se agrupan con TJ/hb1201.](https://www.3tres3.com/3tres3_common/art/mx/13958/arbol-filogenetico-phyml-prv-ge_247362.png?w=820&q=1&t=1653979446)
Imagen 5. Árbol filogenético PhyML - PRV gE que muestra cepas de tipo1 (similar a kaplan/becker), cepas "clásicas" de tipo 2 (similar a Fa/SC/Ea) y cepas de tipo 2 de mayor virulencia (similar a TJ/hb1201). Casos recientes de PRV, este caso [20-1048] y la encefalitis humana PRV hSD1-2019 se agrupan con TJ/hb1201.
Discusión
La enfermedad de Aujeszky (EA), también conocida como " pseudorabia (PRV)", se presentó como una enfermedad neurológica mortal en rumiantes en 1813 y, a menudo, se confundía con la rabia en el ganado bovino y perros. Debido al prurito intenso e incontenible producido por el daño nervioso en el circuito del prurito, la afección se conocía como "picor loco" o (mad itch) pero a veces también se la denominaba "parálisis bulbar infecciosa". Durante la década de 1930, R. E. Shope informó que la pseudorabia en Europa y el picor loco en Estados Unidos eran la misma enfermedad y estaba muy extendida y endémica en los cerdos de la mayoría de los países productores porcinos.
El cerdo es el hospedador natural del virus de Aujeszky (ADV) La infección por el ADV puede ser leve y pasar casi desapercibida o producir brotes explosivos con elevada mortalidad. Las diferencias en la virulencia observada del ADV son el resultado de la variación en la cepa del virus, factores animales y factores aleatorios.
Los signos del ADV en cerdos reproductores se manifiestan como una enfermedad respiratoria y un síndrome reproductivo viral con abortos, muerte embrionaria, problemas en el parto, momificaciones, lechones débiles al nacer e infertilidad.
Infección ocular por EA en cerdos no reportada previamente
Los lechones de menos de 6 semanas de edad pueden mostrar signos neurológicos, temblores, ataxia, convulsiones, diarrea, dificultad respiratoria y elevada mortalidad. A menudo, los lechones infectados durante la lactación presentan focos blancos de necrosis en las tonsilas, hígado y, a veces, en el bazo. Los cerdos de mayor edad generalmente muestran signos respiratorios; tos, disnea y un síndrome respiratorio porcino generalizado cuando se complica con problemas coexistentes como infección por micoplasmosis, Actinobacillus pleuropneumoniae (App), estreptococos, peste porcina clásica (PPC), úlceras gástricas y deficiencias en la ventilación. Los signos del sistema nervioso central (SNC) ocurren ocasionalmente en cerdos de engorde con EA, pero rara vez en animales en edad reproductiva. Se pueden observar hemorragias en el riñón. El circovirus porcino tipo 2 (PCV2), PPC, PPA y PRRS deben incluirse en el diagnóstico diferencial o pueden ser coinfecciones.
El ADV se propaga verticalmente mediante cerdas infectadas de forma persistente, fómites, camiones e instalaciones sucias y animales reproductores infectados. Los cerdos de engorde infectados propagan fácilmente el ADV por vía respiratoria dentro de un espacio aéreo. La transmisión por aerosol en distancias de varios kilómetros puede ocurrir en aire frio y húmedo.
La enfermedad de Aujeszky se puede observar en otros animales además de los cerdos, particularmente en bovinos, ovinos, visones, perros y gatos. Los pollitos recién eclosionados son también susceptibles. Se han detectado perros resistentes en granjas porcinas infectadas con ADV, pero generalmente estos animales son susceptibles y mueren tras la aparición de signos en el sistema nervioso central.
¿Debe considerarse la enfermedad de Aujeszky como una zoonosis?
Los humanos son relativamente resistentes. La infección en humanos es extremadamente rara aunque el virus es capaz de replicarse en células humanas en cultivo. Se ha notificado la infección en humanos con signos clínicos leves por exposición a gatos y perros, con recuperación del virus y seroconversión. Recientemente, se han documentado varios casos graves de encefalitis y endoftalmitis en humanos en China entre trabajadores y veterinarios porcinos y operarios de plantas de beneficio. Generalmente, algún antecedente de lesión o trauma se relaciona con una infección humana tan grave. El virus detectado en casos recientes de ADV en humanos se agrupa estrechamente con el ADV detectado en este caso (imagen 5).
¿Hay vacunas buenas y eficaces disponibles?
La vacunación es eficaz para reducir la gravedad y la propagación del ADV. El ADV se puede erradicar con la tecnología actual pero es endémico en gran parte de las principales provincias productoras de cerdos de China, con una prevalencia por granja cercana al 60% en áreas de alta densidad porcina. Las vacunas muertas y vivas modificadas están disponibles en China para su uso en granjas y la mayoría vacunan frente a Aujeszky. Normalmente las vacunas de ADV utilizadas en todo el mundo tienen una deleción en el gen gE que las hace avirulentas en el caso de vacunas vivas modificadas y que confiere capacidad DIVA (diferenciación de animales infectados y vacunados). Las primeras vacunas con deleción de gE fueron la vacuna viva avirulenta de placa pequeña (K) de Bartha (1961) y la vacuna Bucarest (Buk), conocida como "Norden". Se usan vacunas de ADV con deleciones parciales o completas de gE. Usada junto con una estrategia DIVA y el saneamiento/aislamiento con un sistema de producción "Todo dentro/Todo fuera", la vacuna es una herramienta útil para la eliminación y erradicación del Aujeszky. No induce inmunidad esterilizante ni crea una "burbuja mágica" alrededor del cerdo para protegerlo de la infección bajo las fluctuantes condiciones de campo. Sin embargo, las cerdas que se vacunan repetidamente contra ADV producen inmunidad humoral pasiva que protege a sus cerdos de la infección hasta bien entrado el período postdestete. Es improbable que las cerdas vacunadas repetidamente transmitan el virus del ADV a sus lechones o a las primerizas no expuestas. Las vacunas muertas son más eficaces que las vivas modificadas como dosis de recuerdo, pero la experiencia ha demostrado que la vacuna viva modificada puede ser "suficientemente buena" como refuerzo en situaciones en las que no se dispone de vacuna muerta. Cuando las primerizas procedentes de cerdas vacunadas se vacunan, se crían en lotes "Todo dentro/Todo fuera" y entran en una granja de cerdas vacunadas, pueden permanecer negativas y reemplazar progresivamente a las cerdas infectadas. El virus de Aujeszky se ha eliminado en granjas, áreas y países enteros con este método.
Aujeszky de virulencia aumentada
Desde aproximadamente 2011, se han informado variantes de pseudorabia de "virulencia mejorada" en China. Las cepas "occidentales" de Aujeszky como Kaplan, Becker y Bartha pertenecen al grupo tipo 1 (imagen 5). Hay que tener en cuenta que Bartha K-61 tiene una deleción completa de gE. El virus Aujeszky (ADV) "clásico" de China/Asia {Ea, Fa, SC} es de tipo 2. Las cepas variantes de tipo 2 {TJ, hb1201, jsy7-2021,...} están implicadas en brotes recientes de enfermedad de Aujeszky (EA) de "virulencia mejorada" (con patología más grave que el clásico tipo 2). Aujeszky procedente de encefalitis/oftalmitis humana, como el que se muestra en GenBank: MT469550 (hSD1-2019), se está agrupando con el virus 20-1048 detectado en este caso excepcional, así como con cepas de virulencia mejorada (imagen 5). Parte del aumento de la virulencia puede deberse a cambios en la glicoproteína gE, por lo que las vacunas con deleción de tipo Bartha no estimulan la inmunidad, o a cambios en otros loci.
La erradicación de la enfermedad de Aujeszky (EA) es posible y factible, tiene implicaciones importantes en sostenibilidad, seguridad alimentaria y en la salud humana, y eliminaría una fuente importante de pérdidas en las granjas porcinas.




